
摘要:本文对全人源化单克隆抗体制备技术中的转基因小鼠技术进行概述和整理,主要内容包括转基因小鼠制备全人单抗原理简介,优缺点的对比以及四种常用的实验方法介绍。
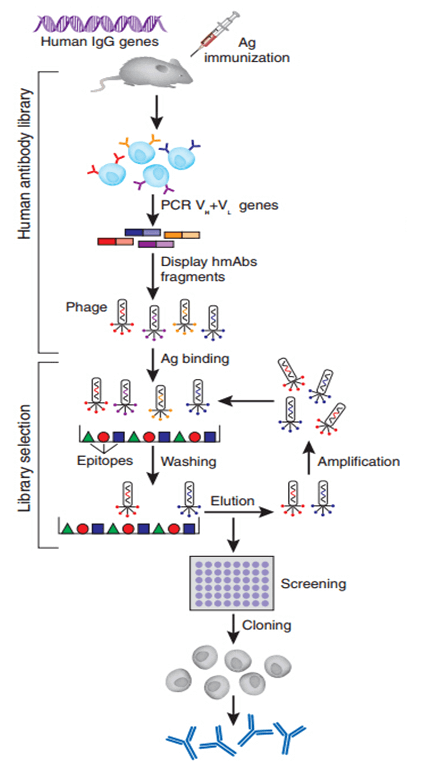
转基因小鼠制备全人源抗体的实验原理是:在抗体生成过程不是从普通小鼠开始,而是从鼠抗体生成基因被相应人基因所取代的小鼠开始。该方法要求人的抗体基因片段在小鼠体内必须进行较为有效的重排与表达,并且这些片段能与小鼠细胞的免疫系统信号机制相互作用,使得小鼠在受抗原刺激后,这些人抗基因片段能被选择,表达并活化B细胞分泌人抗体。其基本方法是采用在鼠胚胎干细胞(ES)中的同源重组来使得鼠原有基因缺失,再通过显微注射等技术将重建的人源抗体胚系基因微位点转入小鼠体内,最终由mAb的杂交瘤分泌出全人序列的抗体。
转基因小鼠制备全人源抗体的主要优点是,其功效要优于其他生产抗正常人体蛋白mAb技术。小鼠识别抗原和动员抗该抗原的抗体系统仍保持完整,容易把人体蛋白识别为异物。而且,由于抗体是在体内产生,经历正常装配和成熟过程,从而保证成品具有较高的靶结合亲和力。另一方面,用转基因小鼠生产候选mAb药物时间较短,费用较低。
转基因小鼠技术目前主要存在以下几个问题。一是免疫耐受的问题, 虽然可以通过免疫佐剂的使用和免疫方法的改进来提高免疫反应强度,但对于一些人类抗原仍然较难获得高亲和力抗体; 二是上述提到的存在鼠源抗体干扰的问题; 三是存在对毒性抗原较难进行免疫等问题。
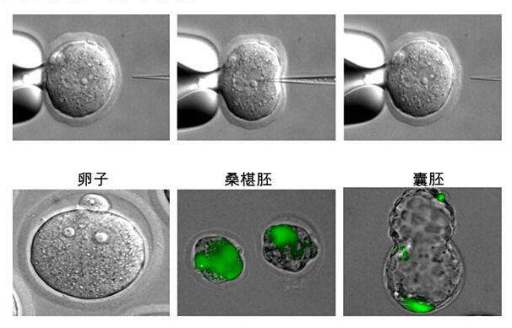
该法又称DNA显微注射法,即通过显微操作仪将外源基因直接用注射器注入受精卵,利用外源基因整合到DNA中,再通过胚胎移植技术将转基因胚胎移植到代孕受体动物子宫中,经过体内发育获得转基因动物。该方法的特点是外源基因的导入整合效率较高,不需要载体,直接转移目的基因,目的基因的长度可达200kb,较少产生嵌合体等。它可以直接获得纯系,所以实验周期短。
然而该方法有一些缺点使其很难在大动物中广泛应用:(1)显微操作仪器昂贵;(2)技术操作复杂,要求经过专门训练的技术人员操作仪器;(3)显微注射导入的外源基因在基因组中随机整合,可能导致内源性功能基因突变或者激活一些致癌基因,无法调控外源基因在基因组中的整合数目(拷贝数);(4)外源基因整合效率较低,构建转基因大动物成本较高;(5)只能实现目的基因的整合,不能进行基因敲除研究。尽管如此,在体细胞核移植技术出现前,显微注射法是被广泛使用和效果最好的转基因技术。
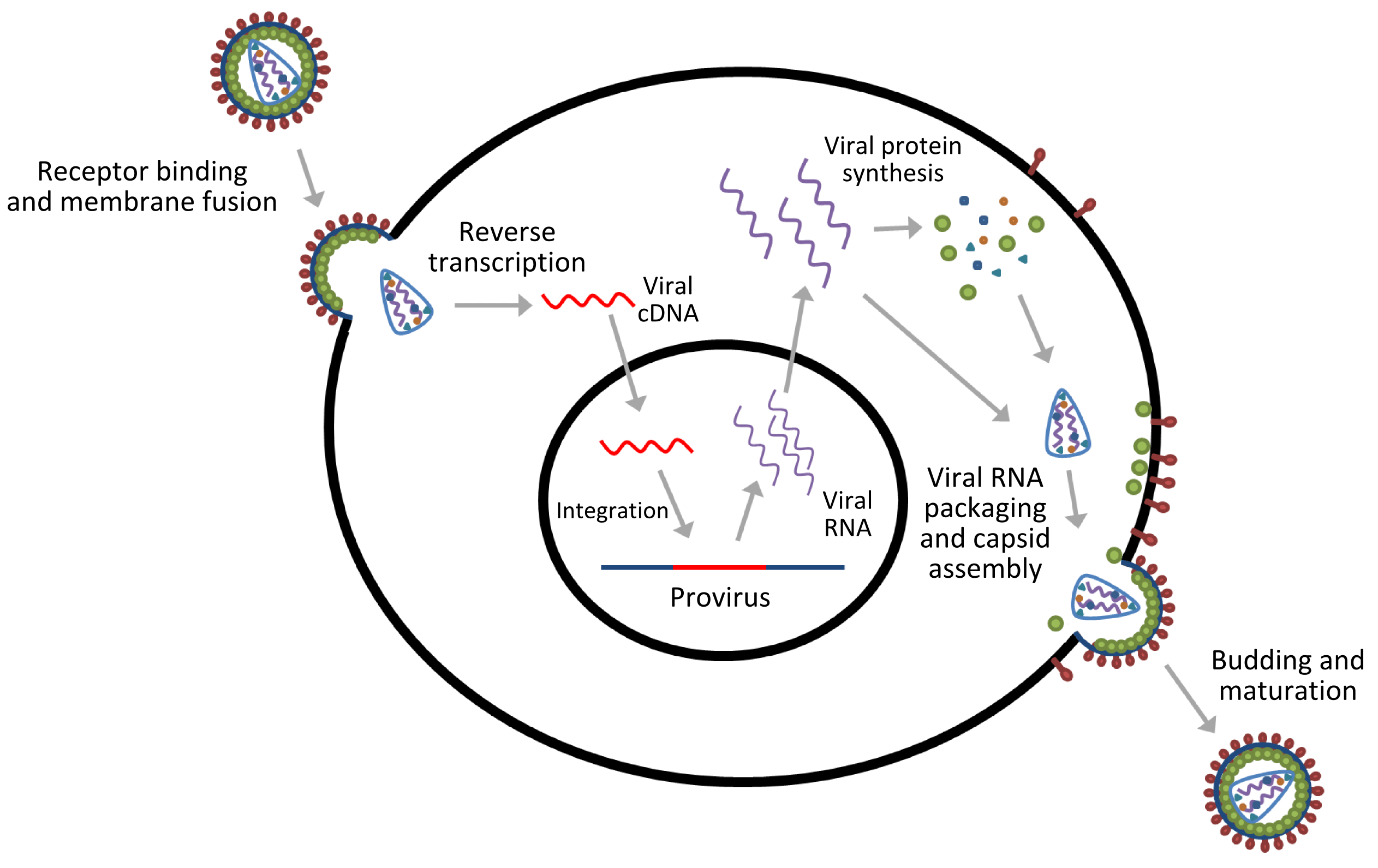
逆转录病毒感染法是最早被用于制备转基因动物的方法。常用的病毒载体包括逆转录病毒载体和慢病毒载体。
该方法首先将目的基因片段克隆至病毒载体的长末端重复序列(long terminal repeat,LTR)的下游,利用病毒系统将含有目的基因的载体包装成高滴度的病毒颗粒,以该病毒颗粒侵染动物受精卵或者胚胎, 也可以直接将胚胎与能释放逆转录病毒的单层培养细胞共孵育以达到感染的目的, 通过病毒将外源目的基因插入整合到宿主基因组DNA中去。这种逆转录病毒被用重组DNA技术修饰后作为基因载体在应用中优于微注射法之处为:无需重排, 可在整合点整合转移基因的单个拷贝;将胚胎置于高浓度病毒容器中, 或者与被感染的细胞体外共同培养, 或微注射鸡胚盘里,整合有逆转录病毒的DNA的胚胎率高。但是逆转录病毒载体具有感染宿主较窄,产生嵌合体动物的概率高等缺点,限制了其在转基因动物制备中的应用。随着病毒载体的发展,目前慢病毒载体逐渐成为病毒载体法的主导方法。
与一般的逆转录病毒载体法相比,慢病毒载体法具有感染宿主范围广,可感染几乎所有类型的细胞(分裂细胞和非分裂细胞),一般对细胞的感染力可达90%以上,具有较强的基因组整合能力。外源基因整合进入基因组织,可以稳定遗传。2010年,刘明军等利用慢病毒载体法制备转基因绵羊,对新生的162只羔羊进行检测,发现其中92只为转基因羔羊,平均转基因效率高达56.8%,显示出慢病毒法高效制备转基因动物的优势。但是慢病毒自身有潜在的致癌性,安全性有待提高,病毒载体容量不够大,目前只能插入小于10kb的外源基因。
近年来利用精子作为外源基因的载体来建立转基因动物极为令人注目。其方法就是将成熟的精子与外源DNA进行预培养之后, 使精子有能力携带外源DNA进入卵子中, 使之受精, 并使外源DNA整合于染色体中。精子携带DNA主要是通过三种途径来完成, 即将外源DNA与精子共孵育、电穿孔导入法和脂质体传染法。该方法简单、方便, 依靠生理受精过程, 免去了原核的损伤。1989年Lavitrano等首次利用小鼠附睾精子与DNA温育产生转基因小鼠。转基因效率高达30%, 外源基因稳定整合到生殖细胞中, 由此获得了转基因株系。所以这些引起了广大科研工作者的极大兴趣, 以精子作为载体、针对不同动物品种的研究工作相继展开。
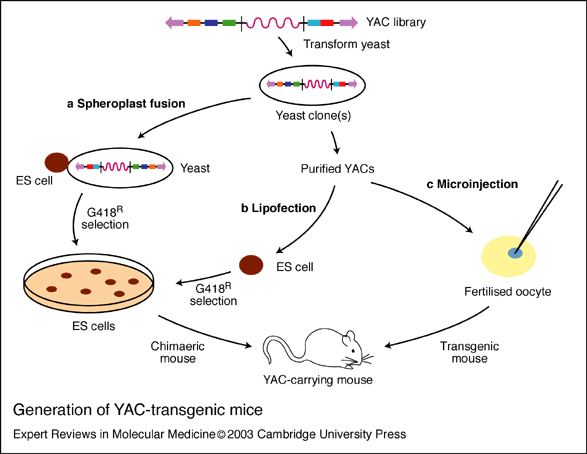
YAC系统是1987年发展起来的。该技术主要是将未重排的人类免疫蛋白胚系基因,首先构建成酵母人工染色体(yeast artificial chromosome,YAC),并把其转人小鼠即可获得分泌人抗体的转基因鼠。Mendez等采用改进的细胞融合法:去掉含有YAC的酵母细胞壁,使其球状原生质与鼠胚干细胞(ES融合)。然后把整合有目的基因的ES细胞导人小鼠囊胚,使之发育为嵌合体小鼠,再通过转基因鼠间反复交筛选,最终可获得分泌完全人抗体的小鼠。分别以人白细胞介素-8(IL-8)、表皮生长因子受体(EGFR)、肿瘤坏死因子-α(TNF-α)和淋巴细胞表面抗原(CD4)等抗原免疫该鼠,再取其脾细胞以杂交瘤技术与鼠骨髓瘤细胞融合。经筛选获得针对上述抗原的分泌高效价人抗体的杂交瘤细胞株。该技术明显优于微基因重组法,所获抗体的亲和力显著提高。但由于大量Ig相邻基因片段的同源重组过程复杂,以及包含所有Ig恒定区基因的YAC克隆困难,到目前还不可能把所有人Ig基因转入小鼠,故产生的抗体类型有限,仅能产生IgM和IgG2。
参考资料:
1.孙志伟, 王双, 陈惠鹏. 转基因小鼠在抗体药物研发中的应用. 军事医学科学院生物工程研究所, 2012
2.吴玉龙, 赵冬梅. 全人源抗体制备技术研究进展. 滨州医学院人体寄生虫学教研室, 2005
3.王锋, 倪培华, 宋巍, 周同. 利用转基因小鼠及转染色体小鼠产生人抗体的研究进展. 上海第二医科大学附属瑞金医院, 2001

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved